| دانلود رایگان مقاله انگلیسی + خرید ترجمه فارسی
|
|
| عنوان فارسی مقاله: |
نقشه برداری دامنه های DNA و اتصال روی در ASR1 (پروتئین رسیدن به استرس ابسیزیک اسید)، یک پروتئین خاص گیاهی تنظیم شده تنش غیرزیستی |
| عنوان انگلیسی مقاله: |
Mapping the DNA- and zinc-binding domains of ASR1 (abscisic acid stress ripening), an abiotic-stress regulated plant specific protein |
|
|
| مشخصات مقاله انگلیسی (PDF) | |
| سال انتشار | 2006 |
| تعداد صفحات مقاله انگلیسی | 8صفحه با فرمت pdf |
| رشته های مرتبط با این مقاله | زیست شناسی |
| گرایش های مرتبط با این مقاله | ژنتیک، علوم گیاهی، میکروبیولوژی و علوم سلولی و مولکولی |
| مجله | بیو شیمی – Biochimie |
| دانشگاه | موسسات علوم کاربردی، دانشگاه بن گوریون، اسرائیل |
| کلمات کلیدی | تنش غیرزنده. اتصال DNA. تنش-نمک. تنش-آب. اتصال-روی. اتصال DNA وابسته به روی |
| شناسه شاپا یا ISSN | ISSN 0300-9084 |
| رفرنس | دارد ✓ |
| لینک مقاله در سایت مرجع | لینک این مقاله در نشریه Elsevier |
| نشریه الزویر |  |
| مشخصات و وضعیت ترجمه فارسی این مقاله (Word) | |
| تعداد صفحات ترجمه تایپ شده با فرمت ورد با قابلیت ویرایش و فونت 14 B Nazanin | 20صفحه |
| ترجمه عناوین تصاویر و جداول | ترجمه شده است ✓ |
| ترجمه متون داخل تصاویر | ترجمه نشده است ☓ |
| درج تصاویر در فایل ترجمه | درج شده است ✓ |
| درج جداول در فایل ترجمه | درج شده است ✓ |
| درج فرمولها و محاسبات در فایل ترجمه به صورت عکس | درج شده است ✓ |
| منابع داخل متن | به صورت عدد درج شده است ✓ |
- فهرست مطالب:
چکیده
1. مقدمه
2. مواد و روش ها
2. 1. مواد گیاهی و استخراج پروتئین های برگ
2.2. ساخت جهش یافته های حذف
2.3. بروز و خالص سازی ASR1 و پروتئین های مشتق شده
2.4. آبکافت اسید ملایم
2.5. اتصال DNA
2. 6. حركت ذرات معلق پروتئین بوسيله نيروي برق
2.7. وسترن بلات (یکی از تکنیک ها و روش های تشخیص پروتئین ها)
2.8. تجزیه پروتئین ها
2.9. MALDI-TOF-MS
3. نتایج
3. 1. نگاشت حوزه فعالیت اتصال DNA از ASR1
3.2. اتصال Zn2+ توسط ASR1
3.3. اتصال-روی باعث تغییرات انطباقی می شود
3. 4. نگاشت حوزه اتصال-روی
4. بررسی
- بخشی از ترجمه:
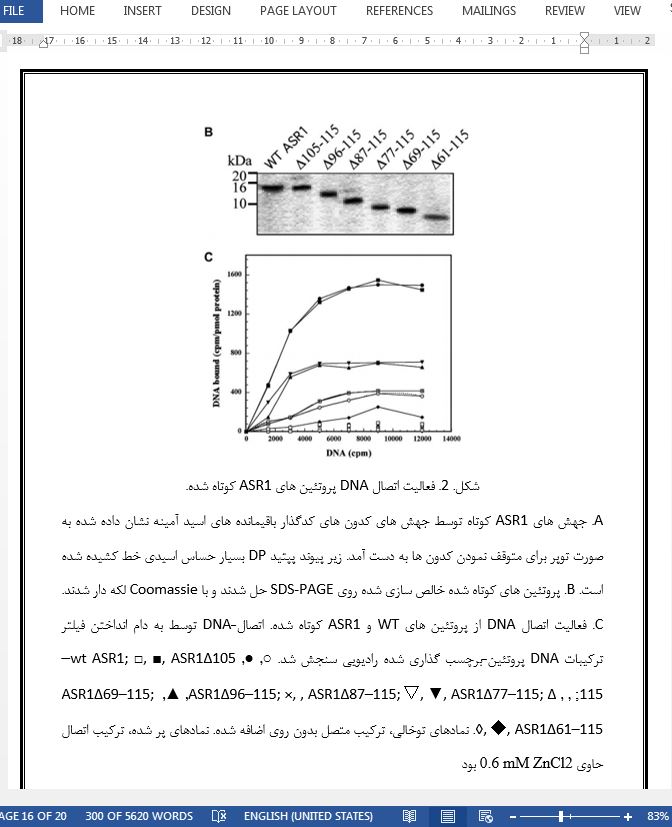
4. بررسی ASR1 دارای فعالیت اتصال DNA وابسته به روی بود [16]. باقی مانده های اسید آمینه و یا حوزه های پروتئینی گنجانده شده در اتصال DNA، و یا روی برای آن موضوع نمی تواند از یک تجزیه و تحلیل توالی یا همولوژی های ساختاری امکان پذیر استنتاج شود. اتصال DNA به باقی مانده های ترمینال -کربوکسی 61-115 بر اساس محصولات به دست آمده توسط آبکافت اسید ملایم نگاشت برداری شد (شکل 1). علاوه بر این، فعالیت اتصال DNA از پایانه-کربوکسی ASR1 وابسته به روی بود که نشان می دهد که این حوزه شامل یک محل (های) اتصال-روی می شود. از سوی دیگر، محل های اتصال-روی با میل زیاد تشخیص داده شده توسط تجزیه و تحلیل های MALDITOF-MS در حوزه ترمینال-آمینو می باشد. با استفاده از یک سری از جهش های کوتاه شدن، باقی مانده های اسید آمینه موجود در اتصال DNA بیشتر نگاشت شد (شکل 2). به نظر نمی رسد که باقی مانده های 105-115 در اتصال-DNA وابسته به روی درگیر هستند، همانطور که حذف آنها روی اتصال DNA تاثیر نمی گذارد. حذف باقی مانده های 96-115 و 87-115 به کاهش عمیق (~ 75٪) در فعالیت اتصال DNA منجر شد که البته هنوز وابسته به روی است. با کمال تعجب، حذف بیشتر پروتئین ASR1 (ASR1Δ77-115 و ASR1Δ69-115) به بهبود فعالیت اتصال DNA (حدود نیمی که از ASR1 نوع وحشی) منجر شد. ما پیشنهاد می کنیم که این مشاهده ظاهرا متناقض از AAVGAGGFAF توالی آبگریز در 77-86 باقی مانده های اسید آمینه از ASR1Δ96-115 کوتاه شده و پروتئین های ASR1Δ87-115 حاصل می شود. این باقیمانده ها ممکن است با یکی دیگر از پچ های آبگریز از پروتئین های کوتاه شده تعامل داشته باشند که احتمالا مانع اتصال DNA می شود. حذف این باقی مانده ها به افزایش میل اتصال DNA برای ASR1Δ77-115 محصول بیشتر کوتاه و ASR1Δ69-115 منجر می شود.
- بخشی از مقاله انگلیسی:
4. Discussion
ASR1 possesses a zinc-dependent DNA-binding activity [16]. The amino acid residues or protein domains involved in the binding of DNA, or zinc for that matter, could not be deduced from either a sequence analysis or possible structural homologies. DNA-binding was mapped to the carboxy-terminal residues 61–115 based on products obtained by mild acid hydrolysis (Fig. 1). Furthermore, the DNA-binding activity of the ASR1 carboxy-terminus was zinc dependent, suggesting that this domain contains a zinc-binding site(s). On the other hand, the high affinity zinc-binding sites detected by MALDITOF-MS analyses are at the amino-terminal domain. Using a series of truncation mutants, the amino acid residues involved in DNA-binding were mapped further (Fig. 2). Residues 105– 115 do not appear to be involved in zinc-dependent DNAbinding, as their omission does not affect DNA-binding. Deletion of residues 96–115 and 87–115 resulted in a profound decrease (~75%) in DNA-binding activity, albeit still being zinc-dependent. Surprisingly, further deletions of the ASR1 protein (ASR1Δ77–115 and ASR1Δ69–115) resulted in improved DNA-binding activity (about half that of the wild type ASR1). We propose that this apparently paradoxical observation results from the hydrophobic sequence AAVGAGGFAF at amino acid residues 77–86 of the truncated ASR1Δ96–115 and ASR1Δ87–115 proteins. These residues may interact with another hydrophobic patch of the truncated proteins, possibly hindering DNA-binding. Removal of these residues results in an increased DNA-binding affinity for the further truncated products ASR1Δ77–115 and ASR1Δ69–115.
|
تصویری از مقاله ترجمه و تایپ شده در نرم افزار ورد |
|
|
| دانلود رایگان مقاله انگلیسی + خرید ترجمه فارسی
|
|
| عنوان فارسی مقاله: |
نقشه برداری دامنه های DNA و اتصال روی در ASR1 (پروتئین رسیدن به استرس ابسیزیک اسید)، یک پروتئین خاص گیاهی تنظیم شده تنش غیرزیستی |
| عنوان انگلیسی مقاله: |
Mapping the DNA- and zinc-binding domains of ASR1 (abscisic acid stress ripening), an abiotic-stress regulated plant specific protein |
|
|
خرید ترجمه فارسی مقاله با فرمت ورد