این مقاله انگلیسی ISI در نشریه Nature در 10 صفحه در سال 2015 منتشر شده و ترجمه آن 22 صفحه میباشد. کیفیت ترجمه این مقاله ویژه – طلایی ⭐️⭐️⭐️ بوده و به صورت کامل ترجمه شده است.
| دانلود رایگان مقاله انگلیسی + خرید ترجمه فارسی | |
| عنوان فارسی مقاله: |
تجزیه و تحلیل چندتوانی حالت پایه پرتئوم |
| عنوان انگلیسی مقاله: |
Proteome Analysis of Ground State Pluripotency |
|
|
|
| مشخصات مقاله انگلیسی | |
| فرمت مقاله انگلیسی | pdf و ورد تایپ شده با قابلیت ویرایش |
| سال انتشار | 2015 |
| تعداد صفحات مقاله انگلیسی | 10 صفحه با فرمت pdf |
| نوع مقاله | ISI |
| نوع ارائه مقاله | ژورنال |
| رشته های مرتبط با این مقاله | زیست شناسی |
| گرایش های مرتبط با این مقاله | میکروبیولوژی ، علوم سلولی و مولکولی ، ژنتیک |
| چاپ شده در مجله (ژورنال) | گزارش های علمی – Scientific Reports |
| ارائه شده از دانشگاه | گروه زیست شناسی سیستم های مولکولی، مرکز تحقیقات علوم سلول، موسسه زیست شناسی و فناوری سلول های بنیادی رویان، تهران، ایران |
| نمایه (index) | scopus – master journals – JCR – MedLine – DOAJ – PubMed Central |
| نویسندگان | Sara Taleahmad – Mehdi Mirzaei – Lindsay M. Parker |
| شناسه شاپا یا ISSN | 2045-2322 |
| شناسه دیجیتال – doi | https://doi.org/10.1038/srep17985 |
| ایمپکت فاکتور(IF) مجله | 4.149 در سال 2019 |
| شاخص H_index مجله | 179 در سال 2020 |
| شاخص SJR مجله | 1.341 در سال 2019 |
| شاخص Q یا Quartile (چارک) | Q1 در سال 2019 |
| بیس | نیست ☓ |
| مدل مفهومی | ندارد ☓ |
| پرسشنامه | ندارد ☓ |
| متغیر | ندارد ☓ |
| رفرنس | دارای رفرنس در داخل متن و انتهای مقاله ✓ |
| کد محصول | 11492 |
| لینک مقاله در سایت مرجع | لینک این مقاله در سایت Nature |
| نشریه | Nature |
| مشخصات و وضعیت ترجمه فارسی این مقاله | |
| فرمت ترجمه مقاله | pdf و ورد تایپ شده با قابلیت ویرایش |
| وضعیت ترجمه | انجام شده و آماده دانلود |
| کیفیت ترجمه | ویژه – طلایی ⭐️⭐️⭐️ |
| تعداد صفحات ترجمه تایپ شده با فرمت ورد با قابلیت ویرایش | 22 (1 صفحه رفرنس انگلیسی) صفحه با فونت 14 B Nazanin |
| ترجمه عناوین تصاویر و جداول | ترجمه شده است ✓ |
| ترجمه متون داخل تصاویر | ترجمه شده است ✓ |
| ترجمه متون داخل جداول | ترجمه شده است ✓ |
| ترجمه ضمیمه | ندارد ☓ |
| ترجمه پاورقی | ندارد ☓ |
| درج تصاویر در فایل ترجمه | درج شده است ✓ |
| درج جداول در فایل ترجمه | درج شده است ✓ |
| درج فرمولها و محاسبات در فایل ترجمه | ندارد ☓ |
| منابع داخل متن | درج نشده است ☓ |
| منابع انتهای متن | به صورت انگلیسی درج شده است ✓ |
| فهرست مطالب |
|
نتایج تحلیل غنی سازی مسیر KEGG بحث نتیجه گیری |
| بخشی از ترجمه |
|
برای توسعه سلولی مستقیم یا حفظ حالت پایه ساده، پتانسیل تمایز سلولهای بنیادی جنینی پرتوان (ESC) را از طریق شرایط سرم و محیط می توان دستکاری نمود. با اضافه کردن بازدارنده های (مهارکنندگان) پروتئین کیناز فعال شده با میتوژن (MAPK) و گلیکوژن سنتاز کیناز 3 (Gsk3) معروف به تیمار 2 بازدارنده (2i)، حالت خودتجدید ESC تحریک و القا می گردد. در اینجا، از شیوه شاتگان پروتئومیکس برای بررسی و پژوهش اختلافات موجود در بیان پروتئین بین 2i و mESCs رشد کرده در محیط سرم استفاده کرده ایم. نتایج بدست آمده نشان داد که 164 پروتئین به صورت افزایشی تنظیم شدند، و 107 پروتئین در سلولهای رشد کرده در محیط 2i در مقایسه با سرم، تنظیم کاهشی شدند.در سلولهای رشد کرده در محیط 2i با بالاترین غنی سازی، مسیرهای پروتئین با گلیکولیز و گلوکونئوژنز ارتباط داشتند. در سلولهای رشد کرده در محیط 2i، مسیرهای پروتئین مرتبط با رشد اندام (ارگان) تنظیم کاهشی شدند. در ESCs رشد کرده در محیط سرم، مسیرهای پروتئین درگیر در چسبندگی انتگرین و چسبندگی کانونی، و علامتدهی پروتئین های درگیر در تنظیم سیتواسکلتون اکتین، غنی شدند. بااین کار تعدادی پروتئین های هسته ای مشاهده کردیم که عمدتاً در حفظ و نگهداری خودتجدید درگیر بوده و در محیط 2iدر مقایسه با سرم، در سطوح بالاتری بیان شدند- Dnmt1, Map2k1، Parp1, Xpo4, Eif3g, Smarca4/Brg1 و Smarcc1/Baf155 . در کل، نتایج بدست آمده بینش هایی در رابطه با مسیرهای کلیدی پروتئین ارائه نمود که ESCs از آنها در شرایط پایه یا ناپایدار محیط کشت 2i یا سرم استفاده نمودند.
تحلیل وسترن بلات مقدار مساوی از پروتئین ها (50 μ g) از تکرارهای بیولوژیکی برروی 12 درصد ژل SDS-PAGE جدا شدند. با رنگ آمیزی ژلهای SDS-PAGE با استفاده از Coomassie Brilliant Blue، یکنواختی مقدار پروتئین بارگذاری شده برروی ژلها نیزمشاهده گردید (شکل S3). برای تحلیل وسترن بلات، پروتئین ها به روش الکتروفورتیک به غشاهای پلی وینیلیدین دی فلوئورید منتقل شدند (Bio-Rad). بلات ها با (tris-HCl, pH 7.6, 150 mM NaCl, and 0.1%ween-20), 20 mM)، محتوی 5 درصد BSA بلاکه شده، سپس عملیات انکوباسیون با محلول آنتی بادی اولیه به صورت شبانه در دمای 4 درجه سانتی گراد انجام شد. پس از شستشو با TBST، غشاها با آنتی بادی ثانویه مزدوج شده با هورس رادیش پروکسیداز (HRP) در دمای اتاق به مدت 1 ساعت انکوبه شدند. با استفاده از Hyperfilm (GE) سیگنالها با سوبسترای ECL (GE) تشخیص داده شدند. جدول تکمیلی S3 آنتی بادیهای اولیه و ثانویه استفاده شده را نشان می دهد. از Gapdh به عنوان کنترل بارگذاری استفااده گردید. باندها یا نوارهای پروتئین بااستفاده از نرم افزار ImageJ تعیین شدند. حجم هر باند با استفاده از آزمون تی استودنت مورد تجزیه و تحلیل قرار گرفت. |
| بخشی از مقاله انگلیسی |
|
The differentiation potential of pluripotent embryonic stem cells (ESCs) can be manipulated via serum and medium conditions for direct cellular development or to maintain a naïve ground state. The selfrenewal state of ESCs can thus be induced by adding inhibitors of mitogen activated protein kinase (MAPK) and glycogen synthase kinase-3 (Gsk3), known as 2 inhibitors (2i) treatment. We have used a shotgun proteomics approach to investigate differences in protein expressions between 2i- and serum-grown mESCs. The results indicated that 164 proteins were significantly upregulated and 107 proteins downregulated in 2i-grown cells compared to serum. Protein pathways in 2i-grown cells with the highest enrichment were associated with glycolysis and gluconeogenesis. Protein pathways related to organ development were downregulated in 2i-grown cells. In serum-grown ESCs, protein pathways involved in integrin and focal adhesion, and signaling proteins involved in the actin cytoskeleton regulation were enriched. We observed a number of nuclear proteins which were mostly involved in selfrenewal maintenance and were expressed at higher levels in 2i compared to serum – Dnmt1, Map2k1, Parp1, Xpo4, Eif3g, Smarca4/Brg1 and Smarcc1/Baf155. Collectively, the results provided an insight into the key protein pathways used by ESCs in the ground state or metastable conditions through 2i or serum culture medium, respectively.
Western blot analysis Equal amount of proteins (50μg) from three biological replicates were separated on a 12% SDS-PAGE gel and. The uniformity of the protein amount loaded on the gels was also visulized by staining SDS-PAGE gels using Coomassie Brilliant Blue (Fig. S3). For Western blot analysis, proteins were electrophoretically transferred onto polyvinylidine difluoride membranes (Bio-Rad). The blots were blocked with TBST (20mM tris-HCl, pH 7.6, 150mM NaCl, and 0.1%ween-20), containing 5% BSA, followed by incubation with primary antibody solution overnight at 4 °C. After washing with TBST, the membranes were incubated with horseradish peroxidase (HRP)-conjugated secondary antibody at room temperature for 1h. Signals were detected with ECL substrate (GE) using Hyperfilm (GE). Supplemental Table S3 represents the primary and secondary antibodies used. Gapdh was used as the loading control. Protein bands were quantified by using ImageJ software. The volume of each band was analyzed using student’s t-test. |
|
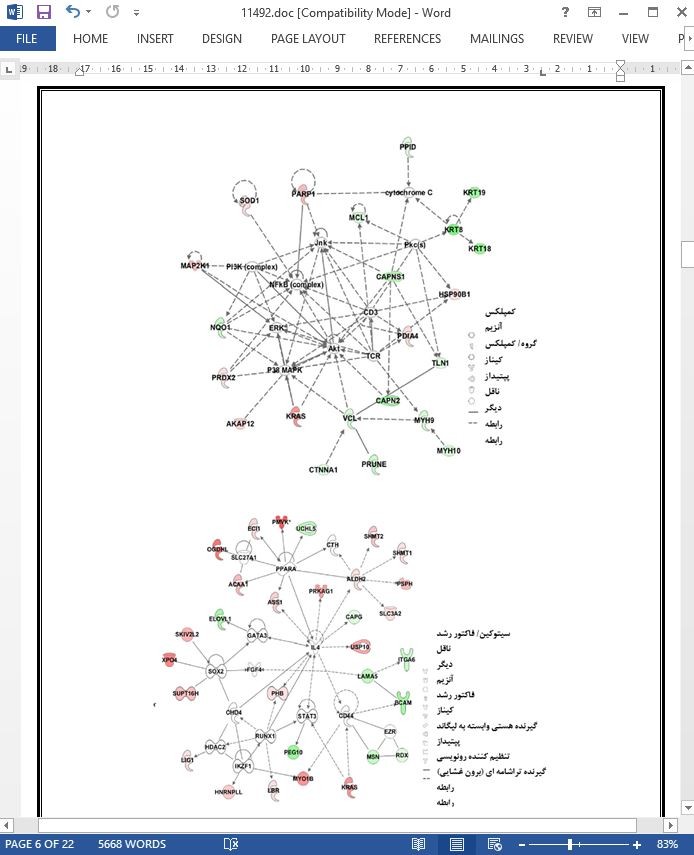
تصویری از مقاله ترجمه و تایپ شده در نرم افزار ورد |
|
|
| دانلود رایگان مقاله انگلیسی + خرید ترجمه فارسی | |
| عنوان فارسی مقاله: |
تجزیه و تحلیل چندتوانی حالت پایه پرتئوم |
| عنوان انگلیسی مقاله: |
Proteome Analysis of Ground State Pluripotency |
|
|
|