این مقاله انگلیسی ISI در نشریه اسپرینگر در 11 صفحه در سال 2016 منتشر شده و ترجمه آن 21 صفحه میباشد. کیفیت ترجمه این مقاله ویژه – طلایی ⭐️⭐️⭐️ بوده و به صورت کامل ترجمه شده است.
| دانلود رایگان مقاله انگلیسی + خرید ترجمه فارسی | |
| عنوان فارسی مقاله: |
اسپکتومتری UV-مرئی گروه جانبی تیروزین در پژوهش ساختار پروتئین. بخش 1: اصول پایه ای و خواص کروموفور تیروزین |
| عنوان انگلیسی مقاله: |
UV–Vis spectroscopy of tyrosine side-groups in studies of protein structure. Part 1: basic principles and properties of tyrosine chromophore |
|
|
|
| مشخصات مقاله انگلیسی (PDF) | |
| سال انتشار مقاله | 2016 |
| تعداد صفحات مقاله انگلیسی | 11 صفحه با فرمت pdf |
| نوع مقاله | ISI |
| نوع نگارش | مقاله مروری (Review Article) |
| نوع ارائه مقاله | ژورنال |
| رشته های مرتبط با این مقاله | فیزیک و شیمی |
| گرایش های مرتبط با این مقاله | فیزیک کاربردی، شیمی فیزیک و شیمی تجزیه |
| چاپ شده در مجله (ژورنال) | بررسی های بیوفیزیکی – Biophysical Reviews |
| کلمات کلیدی | پراکندگی رامان رزونانس، فنول، پارا –کرسول، N-استیل-L-تیروزین آمید، جذب UV- مرئی، فلورسانس، دو رنگ نمایی دورانی و خطی |
| کلمات کلیدی انگلیسی | Phenol – para-cresol – N-acetyl-L-tyrosine amide – UV–Vis absorption – Fluorescence – Linear and circular dichroism – Resonance Raman scattering |
| ارائه شده از دانشگاه | بخش بیوفیزیک، موسسه فیزیک تجربی، دانشکده فیزیک، دانشگاه ورشو، لهستان |
| نمایه (index) | Scopus – PubMed Central |
| نویسندگان | Jan M. Antosiewicz، David Shugar |
| شناسه شاپا یا ISSN | ISSN 1867-2469 |
| شناسه دیجیتال – doi | https://doi.org/10.1007/s12551-016-0198-6 |
| ایمپکت فاکتور(IF) مجله | 4.061 در سال 2018 |
| شاخص H_index مجله | 26 در سال 2019 |
| شاخص SJR مجله | 1.517 در سال 2018 |
| شاخص Q یا Quartile (چارک) | Q2 در سال 2018 |
| بیس | نیست ☓ |
| مدل مفهومی | ندارد ☓ |
| پرسشنامه | ندارد ☓ |
| متغیر | ندارد ☓ |
| رفرنس | دارای رفرنس در داخل متن و انتهای مقاله ✓ |
| کد محصول | 9772 |
| لینک مقاله در سایت مرجع | لینک این مقاله در سایت Springer |
| نشریه اسپرینگر |  |
| مشخصات و وضعیت ترجمه فارسی این مقاله (Word) | |
| وضعیت ترجمه | انجام شده و آماده دانلود در فایل ورد و PDF |
| کیفیت ترجمه | ویژه – طلایی ⭐️⭐️⭐️ |
| تعداد صفحات ترجمه تایپ شده با فرمت ورد با قابلیت ویرایش | 21 صفحه (شامل 1 صفحه رفرنس انگلیسی) با فونت 14 B Nazanin |
| ترجمه عناوین تصاویر | ترجمه شده است ✓ |
| ترجمه متون داخل تصاویر | ترجمه شده است ✓ |
| درج تصاویر در فایل ترجمه | درج شده است ✓ |
| درج فرمولها و محاسبات در فایل ترجمه | به صورت عکس درج شده است ✓ |
| منابع داخل متن | به صورت انگلیسی درج شده است ✓ |
| منابع انتهای متن | به صورت انگلیسی درج شده است ✓ |
| فهرست مطالب |
|
مقدمه اصول اساسی طیفسنجی پراکندگی، انتشار و جذب UV-مرئی ویژگیهای آزمایشی ویژگیهای نوری کروموفور تیروزین جذب UV در کروموفور تیروزین فلورسانس کروموفور تیروزین دو رنگ نمایی خطی کروموفور تیروزین دو رنگ نمایی دورانی کروموفور تیروزین طیفسنجی رامان رزونانس کروموفور تیروزین نتیجهگیری |
| بخشی از ترجمه |
|
چکیده ویژگیهای طیفسنجی ترکیبات تیروزین ممکن است در مطالعات ساختاری پروتئینها مورد استفاده قرار گیرند. در اینجا ما در مورد چندین نوع طیفسنجی UV- مرئی مانند طیفسنجی نرمال، متفاوت و جذب UV مشتق دوم ، طیفسنجی فلورسانس، طیفسنجی دورنگ نمایی دورانی و خطی ، و طیفسنجی رامان و ویژگیهای نوری مربوط به کروموفور تیروزین و فنول که برای مطالعه ساختار پروتئین مورد استفاده قرار میگیرد، بحث میکنیم.
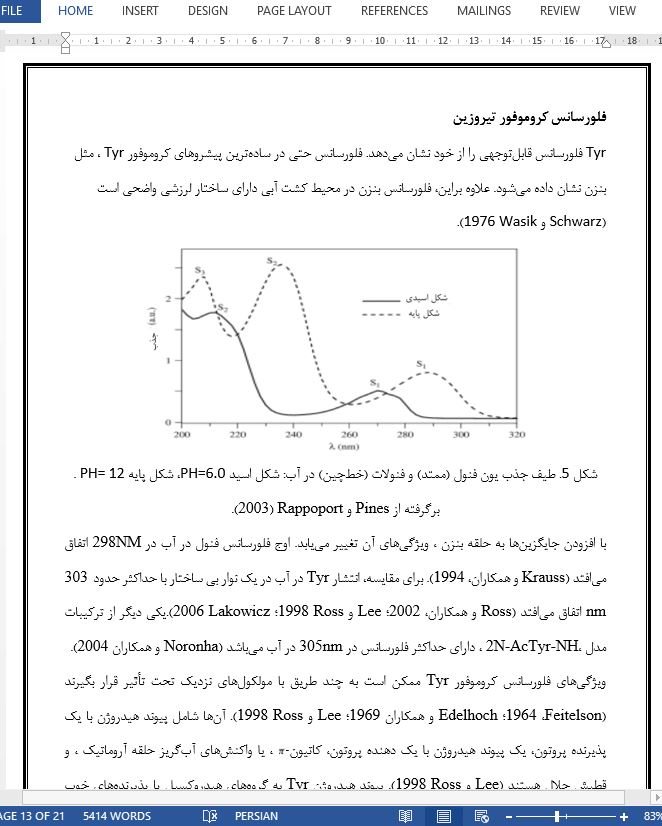
طیفسنجی رامان رزونانس کروموفور تیروزین شکل 9 طیف رامان بنزنهای مایع را برای چندین طولموج تحریک نزدیک 250 nm نشان میدهد که تا 0.25 nm تفکیک شدهاند (Willitsford و همکاران، 2013). این فرکانسهای تحریک متعلق به اولین ناحیه تحریک شده از این مولکول هستند . برای انجام یک مقایسه معنادار، پسزمینه هر یک از طیفها از نظر تغییر در توان لیزر به عنوان تابعی از طولموج تنظیم کننده تصحیح شد و برای از بین بردن وابستگی v4 رامان ذاتی، نرمالیزه شد. در شکل 9، میتوان افزایش رزونانس پراکندگی رامان را در حدود طولموج جذب اوج 259 nm، مشاهده کرد. دو حالت لرزشی ، اوجهای شدید رامان را نشان میدهند که یکی حدود 992 cm-1 و دیگری حدود 1210 cm-1 است. فرکانس 992 cm-1 به مجموع حالت تنفس حلقه بنزن متقارن مربوط میشود (Willitsford و همکاران ، 2013؛ Ziegler و Hudson1981؛ Asher و Johnson، 1985)، که با استفاده از توافقنامه ویلسون (Wilson 1934) با نماد عنوان گذاری شده است. بر اساس توافقنامه ویلسون، دومین افزایش رزونانس اوج رامان در ∼1200 cm−1 به عنوان حالت لرزشی v15 تقویت شده (1150 cm-1) تفسیر شد (Willitsford و همکاران، 2013). یک تصویر گرافیکی از دو حالت نرمال بنزن تخصیصیافته به باندهای افزایش رامان، در تحریک با تابش 259 –nm مشاهده شد که در شکل 10 نشان داده شده است. |
| بخشی از مقاله انگلیسی |
|
Abstract Spectroscopic properties of tyrosine residues may be employed in structural studies of proteins. Here we discuss several different types of UV–Vis spectroscopy, like normal, difference and second-derivative UV absorption spectroscopy, fluorescence spectroscopy, linear and circular dichroism spectroscopy, and Raman spectroscopy, and corresponding optical properties of the tyrosine chromophore, phenol, which are used to study protein structure.
Resonance Raman spectroscopy of tyrosine chromophore Figure 9 shows Raman spectra of liquid benzene for several excitation wavelengths near 259 nm, separated by 0.25 nm (Willitsford et al. 2013). These excitation frequencies belong to the region of the first excited state of this molecule (1Lb). To make the comparison meaningful, each spectrum has been corrected for background, for changes in laser power as a function of tuning wavelength, and normalized to remove the inherent Raman v4 dependence. In Fig. 9 one can see resonance-enhanced Raman scatter around the 259-nm peak absorption wavelength. Two vibrational modes give intensive Raman peaks, one around 992 cm−1 and the other around 1210 cm−1. The frequency 992 cm−1 corresponds to the totally symmetric benzene ring breathing mode (Willitsford et al. 2013; Ziegler and Hudson 1981; Asher and Johnson 1985), labeled by using the Wilson convention (Wilson 1934) with the ν1 symbol. The second resonance-enhanced Raman peak at ∼1200 cm−1 was interpreted as the strengthened v15 (1150 cm−1) vibrational mode according to the Wilson convention (Willitsford et al. 2013). Graphic representation of the two normal modes of benzene assigned to the enhanced Raman bands observed in the excitation with 259-nm radiation is shown in Fig. 10. |
|
تصویری از مقاله ترجمه و تایپ شده در نرم افزار ورد |
|
|
| دانلود رایگان مقاله انگلیسی + خرید ترجمه فارسی | |
| عنوان فارسی مقاله: |
اسپکتومتری UV-مرئی گروه جانبی تیروزین در پژوهش ساختار پروتئین. بخش 1: اصول پایه ای و خواص کروموفور تیروزین |
| عنوان انگلیسی مقاله: |
UV–Vis spectroscopy of tyrosine side-groups in studies of protein structure. Part 1: basic principles and properties of tyrosine chromophore |
|
|
|