این مقاله انگلیسی ISI در نشریه الزویر در 7 صفحه در سال 2000 منتشر شده و ترجمه آن 8 صفحه میباشد. کیفیت ترجمه این مقاله ویژه – طلایی ⭐️⭐️⭐️ بوده و به صورت کامل ترجمه شده است.
| دانلود رایگان مقاله انگلیسی + خرید ترجمه فارسی
|
|
| عنوان فارسی مقاله: |
نانو موتور بیولوژیکی، ATP سنتاز FoF1: از کاتالیز به چرخش زیرواحد مونتاژ γεc10-12 |
| عنوان انگلیسی مقاله: |
Biological nano motor, ATP synthase FoF1 : from catalysis to γεc10-12 subunit assembly rotation |
|
|
| مشخصات مقاله انگلیسی (PDF) | |
| سال انتشار | 2000 |
| تعداد صفحات مقاله انگلیسی | 7صفحه با فرمت pdf |
| رشته های مرتبط با این مقاله | زیست شناسی |
| گرایش های مرتبط با این مقاله | بیوشیمی و میکروبیولوژی |
| مجله | مجله بیوشیمی و بیوفیزیک – Biochimica et Biophysica Acta |
| دانشگاه | بخش علوم زیستی، موسسه تحقیقات علمی و تحقیقاتی، دانشگاه اوساکا، ژاپن |
| شناسه شاپا یا ISSN | ISSN 0005-2728 |
| رفرنس | دارد ✓ |
| لینک مقاله در سایت مرجع | لینک این مقاله در نشریه Elsevier |
| نشریه | الزویر – Elsevier |
| مشخصات و وضعیت ترجمه فارسی این مقاله (Word) | |
| تعداد صفحات ترجمه تایپ شده با فرمت ورد با قابلیت ویرایش و فونت 14 B Nazanin | 8 صفحه |
| ترجمه عناوین تصاویر | ترجمه شده است ✓ |
| ترجمه متون داخل تصاویر | ترجمه نشده است ☓ |
| درج تصاویر در فایل ترجمه | درج شده است ✓ |
| منابع داخل متن | درج نشده است ☓ |
- فهرست مطالب:
چکیده
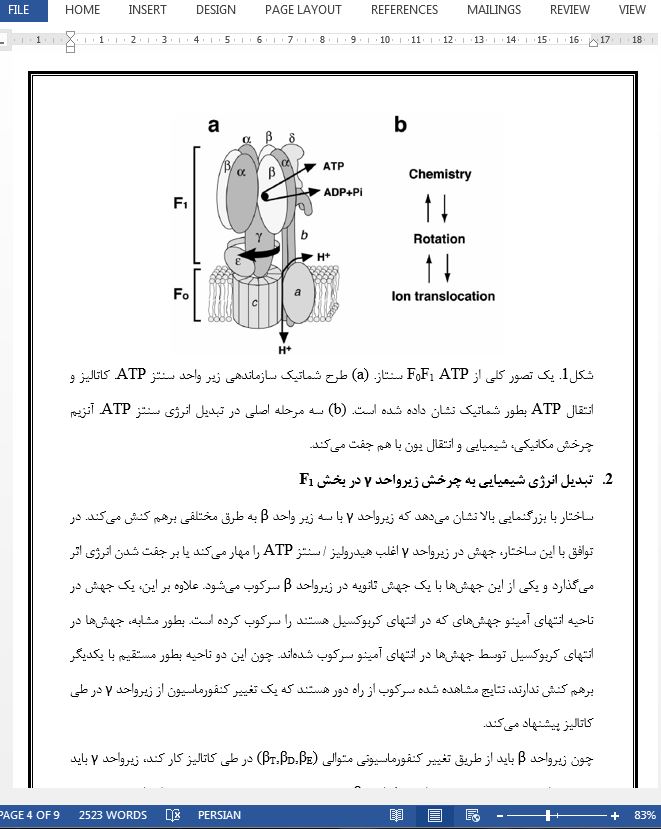
1. کاتالیز و اساس ساختاری F0F1
2. تبدیل انرژی شیمیایی به چرخش زیرواحد γ در بخش F1
3. چرخش مونتاژ زیرواحدی εγc10-12
3.1 چرخش الیگومر زیرواحد c
3.2. مطالعات بعدی (بیشتر) بر روی نانو موتور
- بخشی از ترجمه:
3.2. مطالعات بعدی (بیشتر) بر روی نانو موتور
این منطقی است که فرض شود که بخش ثابت و بخش متحرک می توانند قابل تعویض باشند چون هیچ بخشی از F0F1 در غشا ثابت نشده است. بنابراین، هنگامی که روتور مونتاژ εγc10-12 بی حرکت است زیرواحدهای بخش ثابت از F1 مانند α و β باید بچرخند. ما این سوال توسط ثابت کردن زیرواحد c بر روی یک سطح شیشه ای و اتصال یک فیلامنت اکتین به زیرواحد α آزمایش کردیم. با این راه اندازی تجربی، انتظار می رفت چرخش فیلامنت تنها هنگامی که مونتاژ εγc10-12 یک واحد مکانیکی تشکیل می دهد انجام شود. زیرواحدهای α و c به ترتیب به برچسب بیوتین (بیوتین ترانس کربوکسیلاز متصل به دمین) و برچسب های His، با مهندسی ژنتیک متصل شدند؛ بنابراین هیچ مواد شیمیایی برای دستیابی به ویژگی اتصال فیلامنت اکتین لازم نبود (شکل 2d). فیلامنت اکتین، متصل به زیرواحد α، می توانست با هیدرولیز ATP بچرخد و نیروی گشتاور حدود 40 pN nm تولید کند. این مشاهده به خط دیگر از شواهد افزوده شده که نشان دهنده این هستند که F0F1 یک آنزیم چرخش دهنده است و چرخش مونتاژ زیرواحد c و γ یک ویژگی ضروری جفت کنندگی انرژی بین انتقال پروتون و هیدرولیز/ سنتز ATP است.
- بخشی از مقاله انگلیسی:
3.2. Further studies on a nano motor
It is logical to assume that the stator and rotor could be interchangeable because no part of FoF1 is immobilized in the membrane. Thus, stator subunits of F1 such as K and L should rotate when the rotor OQc10ÿ12 assembly is immobilized. We examined this question by ¢xing the c subunit on a glass surface and connecting an actin ¢lament to the K subunit (Y. Sambongi, Y. Iko, M. Tanabe, A. IwamotoKihara, L.P. Nga, I. Ueda, Y. Wada and M. Futai, submitted for publication). With this experimental setup, rotation of the ¢lament would be expected only if the OQc10ÿ12 assembly formed a mechanical unit. The K and c subunits were connected with biotin tag (transcarboxylase biotin binding domain) and His-tags, respectively, by genetic engineering; thus no chemistry was required to achieve speci¢city of the attachment of actin ¢lament (Fig. 2d). The actin ¢lament, attached to the K subunit, could rotate upon ATP hydrolysis and generate torque of V40 pN nm. This observation added another line of evidence indicating that FoF1 is a rotating enzyme and that rotation of the Q and c subunit assembly is an essential feature of the energy coupling between proton transport and ATP hydrolysis/synthesis.
|
تصویری از مقاله ترجمه و تایپ شده در نرم افزار ورد |
|
|
| دانلود رایگان مقاله انگلیسی + خرید ترجمه فارسی
|
|
| عنوان فارسی مقاله: |
نانو موتور بیولوژیکی، ATP سنتاز FoF1: از کاتالیز به چرخش زیرواحد مونتاژ γεc10-12 |
| عنوان انگلیسی مقاله: |
Biological nano motor, ATP synthase FoF1 : from catalysis to γεc10-12 subunit assembly rotation |
|
|