این مقاله انگلیسی ISI در نشریه تیلور و فرانسیس در 21 صفحه در سال 2018 منتشر شده و ترجمه آن 19 صفحه میباشد. کیفیت ترجمه این مقاله ویژه – طلایی ⭐️⭐️⭐️ بوده و به صورت کامل ترجمه شده است.
| دانلود رایگان مقاله انگلیسی + خرید ترجمه فارسی | |
| عنوان فارسی مقاله: |
نشانگرهای زیستی حالت ردوکس تومور در پاسخ به تلفیق مسیرهای آنتی اکسیدانی گلوتاتیون و تیوردوکسین |
| عنوان انگلیسی مقاله: |
Biomarkers of tumor redox status in response to modulations of glutathione and thioredoxin antioxidant pathways |
|
|
|
| مشخصات مقاله انگلیسی | |
| فرمت مقاله انگلیسی | pdf و ورد تایپ شده با قابلیت ویرایش |
| سال انتشار | 2018 |
| تعداد صفحات مقاله انگلیسی | 21 صفحه با فرمت pdf |
| نوع مقاله | ISI |
| نوع نگارش | مقاله پژوهشی (Research Article) |
| نوع ارائه مقاله | ژورنال |
| رشته های مرتبط با این مقاله | پزشکی، زیست شناسی |
| گرایش های مرتبط با این مقاله | علوم سلولی و مولکولی، میکروبیولوژی، ایمنی شناسی |
| چاپ شده در مجله (ژورنال) | تحقیقات رادیکال آزاد – Free Radical Research |
| کلمات کلیدی | تومور، وضعیت ردوکس، پروب چرخشی، roGFP، اورانوفین |
| کلمات کلیدی انگلیسی | tumor – redox status – spin probe – roGFP – auranofin |
| ارائه شده از دانشگاه | دانشگاه کاتولیک لوون (UCL)، موسسه تحقیقات دارویی لوون، گروه تشدید مغناطیسی زیست پزشکی، بلژیک |
| نمایه (index) | scopus – master journals – JCR – MedLine |
| نویسندگان | Julie Kengen – Jean-Philippe Deglasse – Marie-Aline Neveu |
| شناسه شاپا یا ISSN | 1029-2470 |
| شناسه دیجیتال – doi | https://doi.org/10.1080/10715762.2018.1427236 |
| ایمپکت فاکتور(IF) مجله | 3.609 در سال 2020 |
| شاخص H_index مجله | 121 در سال 2021 |
| شاخص SJR مجله | 0.861 در سال 2020 |
| شاخص Q یا Quartile (چارک) | Q2 در سال 2020 |
| بیس | نیست ☓ |
| مدل مفهومی | ندارد ☓ |
| پرسشنامه | ندارد ☓ |
| متغیر | ندارد ☓ |
| فرضیه | ندارد ☓ |
| رفرنس | دارای رفرنس در داخل متن و انتهای مقاله ✓ |
| کد محصول | 11660 |
| لینک مقاله در سایت مرجع | لینک این مقاله در سایت Taylor & Francis |
| نشریه | تیلور و فرانسیس – Taylor & Francis |
| مشخصات و وضعیت ترجمه فارسی این مقاله | |
| فرمت ترجمه مقاله | pdf و ورد تایپ شده با قابلیت ویرایش |
| وضعیت ترجمه | انجام شده و آماده دانلود |
| کیفیت ترجمه | ویژه – طلایی ⭐️⭐️⭐️ |
| تعداد صفحات ترجمه تایپ شده با فرمت ورد با قابلیت ویرایش | 19 (4 صفحه رفرنس انگلیسی) صفحه با فونت 14 B Nazanin |
| ترجمه عناوین تصاویر و جداول | ترجمه شده است ✓ |
| ترجمه متون داخل تصاویر | ترجمه شده است ✓ |
| ترجمه متون داخل جداول | ندارد ☓ |
| ترجمه ضمیمه | ندارد ☓ |
| ترجمه پاورقی | ندارد ☓ |
| درج تصاویر در فایل ترجمه | درج شده است ✓ |
| درج جداول در فایل ترجمه | ندارد ☓ |
| درج فرمولها و محاسبات در فایل ترجمه | ندارد ☓ |
| منابع داخل متن | به صورت عدد درج شده است ✓ |
| منابع انتهای متن | به صورت انگلیسی درج شده است ✓ |
| فهرست مطالب |
|
چکیده مقدمه مواد و روش ها لاین های سلولی زنوگرافت در شرایط in vivo شیمیایی تیمار دارویی اندازه گیری EPR در محیط آزمایشگاه اندازه گیری فلوئورسنت دینامیک ردوکس در محیط آزمایشگاه آدنوویروس ها آلودگی با آدنوویروس و درمان اندازه گیری دینامیک نسبت فلوئورسانس 1- (mt‐)roGFP اندازه گیری گلوتاتیون درون سلولی آنالیز ظرفیت آنتی اکسیدانی کل در محیط آزمایشگاه اندازه گیری EPR در شرایط in vivo آنالیز آماری نتایج ارزیابی مهار هدف تشخیص تغییرات ردوکس تومور با استفاده از پروب های سیتوزولی در محیط آزمایشگاه تشخیص تغییرات ردوکس تومور با استفاده از پروب های میتوکندریایی در محیط آزمایشگاه تشخیص تغییرات ردوکس تومور با استفاده از mito-tempo در شرایط in vivo بحث منابع |
| بخشی از ترجمه |
|
چکیده توانایی سلولهای مرکزی سرطان برای حفظ محیط درون سلولی که شدیدا کاهش یافته وابسته به میزان هجوم آن و مقاومت داروها است. سیستم گلوتاتیون و تیوردوکسین برای تنظیم ممانعت ورود ROS ها در فیزیولوژی سلول و برای تحریک اولیه ی تومور و پیشرفت آن، با یکدیگر همکاری می کنند، مسیرهای گلوتاتیون و تیردوکسین به عنوان هدف جدید در سرطان پدیدار شده است. روش های آزمایشگاهی برای تشخیص تغییرات در وضعیت ردوکس تومور در پاسخ به مسیرهای گلوتایتون و تیوردوکسین بوسیله ی مقایسه ی پروب های رزونانس پارامغناطیسی الکترون(EPR) نیتروکساید ردوکس میتوکندریایی و سیتوزولی و تست اعتبارسنجی متقاطع فلوئورسنت دینامیک ردوکس اندازه گیری می شود. بدین منظور، اثر تلفیق کنندگی گلوتاتیون بر بوتیونین سولفوکسیمین(BSO) و مهارکنندگی تیوردوکسین ردوکتاز بر اورانوفین در محیط آزمایشگاه با استفاده از پروب های EPR و roGFP در سلول های سرطان گردن و سینه بررسی شد. در شرایط in vivo موشهایی که دارای زنوگرافت سرطان سینه یا گردن بودند، با تنظیم کننده های گلوتاتیون و تیوردوکسین تیمار شده و با استفاده از پروب چرخش mito-TEMPO بررسی گردیدند. اطلاعات ما به وضوح حاکی از اهمیت استفاده از پروب های چرخشی هدفمند میتوکندریایی برای تشخیص تغییرات در وضعیت ردوکس تومور تحریک شده بوسیله ی تغییردهنده های ردوکس می باشد. بعلاوه باید اعتبار پروب های چرخشی mito- TEMPO درشرایط in vivo از طریق روش های متناوب در شرایط in vivo باید بررسی شود. با این وجود مشخص شده است که پروب چرخشی استفاده شده در شرایط in vivo در زنوگرافت ها، به تغییرات وضعیت ردوکس حساسیت دارند.
مقدمه سلول های سرطانی میزان تولید گونه های اکسیژن فعال را در مقایسه با سلول های عادی افزایش می دهند(1). گزارشات پیشنهاد می کنند که بوسیله ی سطح میانه ای از ROS، سلول های سرطانی می توانند ROS را در غلظت خاصی که برای پیشرفت تومور ضروری است حفظ کنند(2،3). توانایی سلول های سرطانی مرکزی برای حفظ محیط کاهش یافته ی درون سلولی شدیدا وابسته به مقاومت دارویی و هجوم تومور می باشد(4،5). در بیماران، بیان سطح ژن های آنتی اکسیدان انسانی و نشانگرهای اکسیداتیو وابسته به هجوم تومور و تشخیص ضعیف در بیماران آدنوکارسینومای ریه در مراحل اول است(6). همچنین پارامترهای ردوکس تومور با استفاده از تعیین 62Cu‐ATSM PET در بیماران مبتلا به سرطان گردن و سینه اندازه گیری شد(7). بررسی این مورد اخیرا نشان داد که نسبت اکسیداز برخلاف کاهش گلوتاتیون شدیدا وابسته به کنترل ناحیه ی تومورهای HNSCC است(8). نهایتا اینکه، آنالیز 25 گروه از بیماران مبتلا به سرطان سینه نشان داد که بیان زیاد تیوردوکسین و گلوتاتیون و تیوردوکسین ردوکتاز با کاهش شانس زندگی، افزایش شانس کاهش متاستاز و زندگی بدون بیماری در ارتباط است(9). دیگر مطالعات ارتباط زیادی میان سرطان سلول های ریه (10) و کولورکتال(11) را نشان دادند.
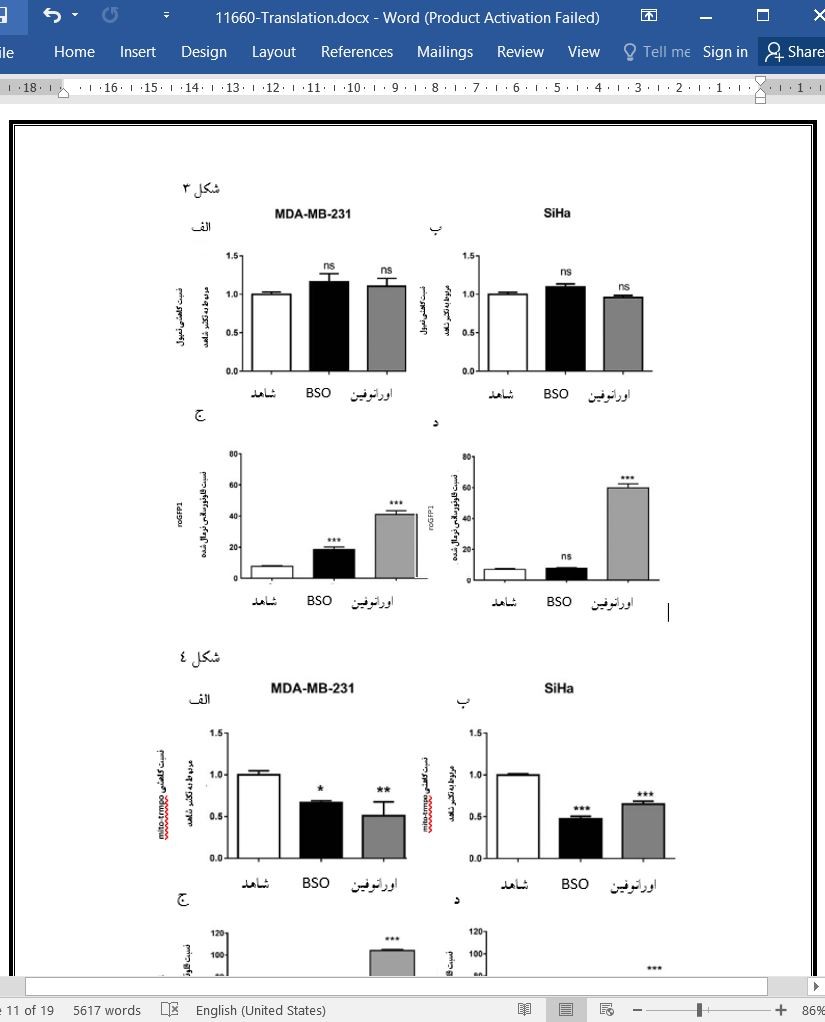
بحث برخلاف سایر تکنیک ها، پروب های چرخشی، توانایی تصویر برداری از وضعیت ردوکس تومور در شرایط in vivo را با استفاده از تصویربرداری EPR یا MRI دارند.(35، 36). اطلاعات ما دو نکته ی مهم در رابطه با تشخیص تغییرات وضعیت ردوکس تومور با استفاده از پروب های چرخشی را نشان می دهد: 1) اهمیت استفاده از پروب های چرخشی با هدف میتوکندریایی برای تشخیص تغییرات در وضعیت ردوکس تومور که در مطالعه ی حاضر در شرایط آزمایشگاه مشخص شد و 2) شناسایی پتانسیل نشان گرهای زیستی ردوکس در پاسخ به تغییرات سیستم گلوتاتیون یا تیوردوکسین در محیط in vivo. با اینکه توانایی داروها برای مقابله با وضعیت ردوکس تومور با استفاده از دوز گلوتاتیون و کیت غیرتخصصی TCA بدست آمد، اطلاعات ما نشان می دهد که پروب چرخشی سیتوزولی tempol برخلاف پروب چرخشی mito-tempo میتوکندریایی، تغییری در وضعیت ردوکس تومور تحریک شده توسط تغییرات مسیرهای گلوتاتیون یا تیوردوکسین در شرایط آزمایشگاه مشخص نکرد. حقیقت این است که کاهش بیشتر سیتوزول نسبت به ماتریکس میتوکندری در سلول های پستانداران ممکن است موجب کاهش حساسیت روش شناسایی در قسمت قبل شود(44،45،46). پروب 1roGFP-mt نیز قادر به نشان دادن تغییرات ایجاد شده توسط BSO یا اورانوفین در هر دولاین سلولی مورد مطالعه بود. این نتایج آزمایشگاهی بدست آمده با نتایج مطالعه ی قبلی که از 2roGFP-1Grx میتوکندریایی و سیتوزولی استفاده شد، در یک راستا هستند، سیتوزول سلول هایی با سنتز معیوب گلوتاتیون، نسبت به تنش اکسیداتیو مقاومت هستند که اکسیداسیون تولید شده در ماتریکس میتوکندری در تیمار BSO معنی دار بود(47). |
| بخشی از مقاله انگلیسی |
|
Abstract The ability of certain cancer cells to maintain a highly reduced intracellular environment is correlated with aggressiveness and drug resistance. Since the glutathione (GSH) and thioredoxin (TRX) systems cooperate to a tight regulation of ROS in cell physiology, and to a stimulation of tumour initiation and progression, modulation of the GSH and TRX pathways are emerging as new potential targets in cancer. In vivo methods to assess changes in tumour redox status are critically needed to assess the relevance of redox-targeted agents. The current study assesses in vitro and in vivo biomarkers of tumour redox status in response to treatments targeting the GSH and TRX pathways, by comparing cytosolic and mitochondrial redox nitroxide electron paramagnetic resonance (EPR) probes, and cross-validation with redox dynamic fluorescent measurement. For that purpose, the effect of the GSH modulator buthionine sulfoximine (BSO) and of the TRX reductase inhibitor auranofin were measured in vitro using both cytosolic and mitochondrial EPR and roGFP probes in breast and cervical cancer cells. In vivo, mice bearing breast or cervical cancer xenografts were treated with the GSH or TRX modulators and monitored using the mito-TEMPO spin probe. Our data highlight the importance of using mitochondria-targeted spin probes to assess changes in tumour redox status induced by redox modulators. Further in vivo validation of the mito-tempo spin probe with alternative in vivo methods should be considered, yet the spin probe used in vivo in xenografts demonstrated sensitivity to the redox status modulators.
Introduction Cancer cells sustain a much higher level of ROS production compared to normal cells [1]. Reports have proposed that, by buffering ROS levels, cancer cells can restrict ROS within a range of concentrations that should favor tumor progression [2, 3]. The ability of certain cancer cells to maintain a highly reduced intracellular environment is therefore strongly correlated with aggressiveness and drug resistance [4, 5]. In patients, the expression levels of human antioxidant genes(HAGs) and oxidative markers were related to tumor aggressiveness and predicted poor outcome in patients with early‐stage lung adenocarcinoma [6]. Also, tumor redox parameters measured by 62Cu‐ATSM PET determined the outcome of patients with head and neck cancer [7]. This is in line with a recent study showing that the ratio of oxidized versus reduced GSH was strongly correlated with locoregional control of HNSCC tumors [8]. Finally, analysis of 25 independent cohorts with 5910 breast cancer patients showed that overexpression of thioredoxin (Trx1) and thioredoxin reductase (TrxR1) was associated with a poor overall survival, distant metastasis‐free survival and disease‐free survival [9]. Other studies showed similar correlations in non‐small cell lung carcinoma [10] and colorectal cancer [11].
Discussion Contrarily to other techniques, spin probes have the potential for in vivo imaging of tumor redox status, using either EPR imaging or MRI [35, 36]. Our data highlight two important findings while assessing the modulation of tumor redox status using spin probes: (i) the importance of using mitochondria‐targeted spin probes to assess changes in tumor redox status, as demonstrated in vitro in the current study, and (ii) the identification of a potential in vivo redox biomarker in response to modulators of the GSH or Trx systems. Despite the ability of the drugs to alter tumor redox status as confirmed using GSH dosage and the non‐ specific ‘TCA’ dosage kit, our data show that the cytosolic spin probe tempol did not detect changes in tumor redox status induced by the modulation of the GSH or Trx pathways in vitro, contrarily to the mitochondrial spin probe mito‐tempo. The fact that the cytosol is maintained more reduced than the mitochondrial matrix in most mammalian cells might reduce the sensitivity of the detection method in the former compartment [44, 45, 46]. The mt‐roGFP1 probe was also able to demonstrate the changesinduced by BSO or auranofin in both cell lines under study. These in vitro results are in line with a previous study, using cytosolic and mitochondrial Grx1‐roGFP2, in which the cytosol of cells with impaired GSH synthesis resisted oxidative stress, while significant oxidation was generated in the mitochondrial matrix upon BSO treatment [47] |
|
تصویری از مقاله ترجمه و تایپ شده در نرم افزار ورد |
|
|
| دانلود رایگان مقاله انگلیسی + خرید ترجمه فارسی | |
| عنوان فارسی مقاله: |
نشانگرهای زیستی حالت ردوکس تومور در پاسخ به تلفیق مسیرهای آنتی اکسیدانی گلوتاتیون و تیوردوکسین |
| عنوان انگلیسی مقاله: |
Biomarkers of tumor redox status in response to modulations of glutathione and thioredoxin antioxidant pathways |
|
|
|